早产儿代谢性骨病筛查和诊断进展
时间: 2025-04-28 作者: 乐鱼app下载官网
早产儿代谢性骨病(metabolic bone disease of pre-maturity,MBDP)是由多种因素共同作用导致早产儿钙磷、骨代谢紊乱而出现骨矿化减少的一种全身性骨骼疾病,如未及时诊治可导致多种不良预后。本文就目前国内外MBDP的筛查和诊断策略进行综述,以期为MBDP的早期筛查及诊断提供帮助。
早产儿代谢性骨病(metabolic bone disease of pre-maturity,MBDP)是由于早产儿体内钙、磷含量不足或骨代谢紊乱导致骨矿化减少、骨脆性增加,严重时可有典型佝偻病影像学表现甚至骨折的全身性骨骼疾病[1 ]。目前报道极低出生体重儿和超低出生体重儿MBDP发病率分别为14.9%~30%[2 ]和50%~60%[3 ]。MBDP如未及时诊治,可导致宫外生长发育迟缓、呼吸机依赖、骨折、身材矮小等不良预后[1 , 4 ],极度影响早产儿的生活品质,因此MBDP的早期筛查和诊断特别的重要。本文就国内外MBDP的筛查和诊断策略进展进行综述。
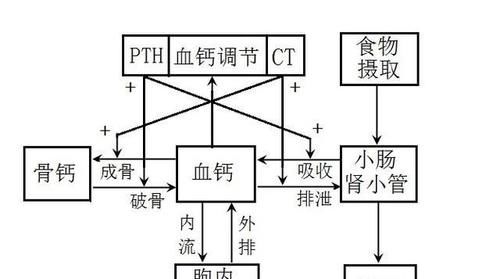
MBDP主要是通过监测血液和尿液生化标志物的特定骨转换指标进行诊断。研究时间最长、最常用的血生化指标包括碱性磷酸酶(alkaline phosphatase level,ALP)、血磷、血钙等。
1.ALP:ALP作为成骨细胞成熟的活性标志物,可以反映新生儿骨骼代谢状态[1 ]。大多数早产儿生后3周出现生理性ALP升高,6~12周达峰值,如果只有少数矿物质摄入则ALP可能进一步升高,提示MBDP[5 ]。ALP升高可早于MBDP临床症状的出现,因此ALP已被广泛用作MBDP的标记物[6 ],但目前缺乏一致的临界值。
2.血磷:血磷浓度是评价骨磷储备的良好指标,低磷血症是MBDP患儿最早期的血液生化特征[7 ]。Xu等[8 ]研究表明,生后预防性补磷能够更好的降低MBDP和骨折发生率。但Perrone等[9 ]研究则显示,早产儿尽管早期补充了钙、磷和维生素D,MBDP的风险仍会增加。
3.血钙:人体内的钙99%储存在骨骼中,余1%则以血钙形式在血液中循环。低血钙时甲状旁腺激素(parathyroid hormone,PTH)可动员骨钙以维持血钙,故MBDP早期机体缺钙时血钙可正常或略升高,到MBDP晚期骨钙储备耗尽时血钙水平才会下降[8 ]。且不同胎龄、不同出生体重的新生儿血钙基线 ]。因此血钙对于早期诊断MBDP毫无意义[7 , 11 ]。
随着医学的进步,PTH、骨钙素、25羟维生素D[25-hydroxyvitamin D,25-(OH)D]和尿液生化标志物等也逐渐被用于MBDP的早期筛查或诊断。当PTH升高时提示钙缺乏,口服补钙有助于调节钙磷代谢、促进骨矿化;当血磷低且PTH正常或降低时,可考虑口服磷酸盐补充剂,但应确保总的肠内钙与磷酸盐摄入比例为1.5~1.7∶1[12 ]。因磷酸盐会与钙结合形成磷酸钙沉淀,导致血钙逐步降低,机体代偿使PTH进一步升高,导致继发性甲状旁腺功能亢进并加重MBDP,故钙与磷酸盐不能同服,且在补磷前应监测PTH[12 , 13 ]。Boddu和Lankala[14 ]研究认为PTH是缺钙的早期敏感标志物,故应监测PTH以识别和治疗潜在的钙代谢紊乱所导致的MBDP。骨钙素是成骨细胞产生的非胶原蛋白,在骨矿化过程中起及其重要的作用[15 ]。25-(OH)D是维生素D在血液循环中的主要存在形式[16 ]。MBDP患儿25-(OH)D可正常、降低或升高,因此不建议将其作为MBDP的筛查和诊断指标[7 ]。尿生化指标包括尿磷、尿钙、尿磷/尿肌酐、尿钙/尿肌酐、肾小管磷酸盐重吸收百分比(tubular reabsorption of phosphorus,TRP)。尿钙和尿磷浓度会随尿量而变化,因此常常要监测肌酐水平以进行标准化[17 ]。尿矿物质与肌酐比值易受饮食摄入及速尿等药物影响,其用于MBDP的诊断仍存在争议[18 ]。TRP的计算公式为[1-(尿磷/尿肌酐)×(血肌酐/血磷)]×100%,正常值为78%~91%。TRP需结合PTH进行解释:如果TRP低而PTH高,提示缺钙;TRP高、PTH低或正常则提示缺磷[19 ]。Czech-Kowalska等[20 ]研究之后发现,TRP97%或尿磷/尿肌酐≤0.74和骨钙素172 ng/ml,在校正胎龄3个月时骨矿化减少的婴儿中诊断MBDP的敏感度为40%,特异度为93%。
当MBDP患儿出现颅骨畸形、肋骨或长骨骨折等典型临床表现,或长骨末端骨质疏松,骨骺处的拔火罐或毛刺样变化,肋骨末端增大,骨膜下新骨形成或骨折等X线片表现时,提示骨矿物质密度已减少20%~40%[18 ],故X线片对MBDP早期筛查的意义不大。
是评估骨矿物质密度的金标准,但其仪器尺寸大、成像时间长,床旁操作可能性小,多次检查可导致辐射剂量累积,以及不可避免的运动伪影等都限制了该技术在新生儿中的广泛应用[21 , 22 ]。
与双能X线吸收法相比,QUS经济便携,可在床旁使用,无电离辐射,重复性高[23 ]。但由于早产儿缺乏QUS的常用参数,即超声传播速度的统一标准参考范围,因此QUS诊断MBDP尚无统一参考标准[1 , 24 ]。
射频超声频谱可提供与双能X线吸收法相同的骨矿物质密度测量结果[25 ],且优点是没有电离辐射,使用起来更便捷[26 ]。更重要的是射频超声频谱可进行从宫内到宫外的纵向研究[19 ]。Perrone等[19 ]提出,在产前使用射频超声频谱识别的MBDP高危儿,生后应监测其生化指标,如果具备ALP500 IU/L,血磷1.0 mmol/L,TRP95%,PTH100 ng/ml,25-(OH)D50 nmol/L其中一项,则应再次行射频超声频谱检查,以评估骨矿物质密度。但该方法目前在早产儿中应用的研究较少,也缺乏相应的文献指南,未来需要更加多的相关研究来实现并创建新的骨矿物质密度诊断和监测策略。
1.英国:英国MBDP的诊断主要是根据ALP和血磷。2008年英国一项针对全国骨矿化减少早产儿的筛查和治疗指南中提出,如新生儿出生体重1 500 g,胎龄≤28周,总肠外营养时间4周或使用过利尿剂、类固醇治疗,应每周监测1次血钙、血磷和ALP;如血磷1.8 mmol/L且ALP500 IU/L,则应监测TRP,TRP95%开始补磷;如血磷无升高,ALP继续升高,则考虑服用骨化醇,鼓励每天进行被动运动,并对利尿剂或类固醇类药物使用情况做评估,如病情允许尽早停用
17 ]。2020年的一项全国性调查指出,英国新生儿科医生在对MBDP的筛查、诊断、监测和指导适当补充治疗方面,未能充分的利用PTH[13 ]。
美国常用血磷、ALP和X线年美国儿科学会建议对出生体重1 500 g的早产儿在生后4~5周常规监测血磷和ALP,如果血清ALP800~1 000 IU/L,血磷1.2 mmol/L,或有疑似骨折表现,应进行X线评估,并最大限度地增加钙和磷的摄入[27 ]。2014年的美国筛查实践认为,ALP用于诊断MBDP的范围为300~1 000 IU/L,58.6%的医疗机构以ALP500 IU/L为诊断标准,在平均胎龄29周的早产儿群体中ALP700 IU/L的敏感度(73%)和特异度(74%)最高[28 ]。另一项在德克萨斯州进行的前瞻性研究则显示,PTH诊断重度MBDP的敏感度高于ALP(71%比29%),且特异度基本一致(88%比93%),PTH联合血磷1.5 mmol/L时,诊断MBPD的灵敏度和特异度分别上升至100%和94%[29 ]。
2023年欧洲一项面向22个国家的调查研究显示,MBDP的诊断程序和管理策略存在很大差异,在筛查和诊断MBDP方面应用最多的是ALP(100%)、血磷(95%)和血钙(95%),尿液标志物和X线片等则很少使用。常用生化指标为血钙2.2 mmol/L、血磷1.8 mmol/L、ALP800 IU/L或500 IU/L和PTH40~100 pg/ml[30 ]。意大利Faienza等[21 ]提出的筛查策略为:对于出生体重1 500 g,胎龄28周,全肠外营养时间4周,经常使用利尿剂或皮质醇等不利于骨骼生长药物的早产儿,应在生后4~6周开始每2周监测1次ALP、血磷、血钙和TRP,若结果正常则监测该早产儿是否长期暴露于危险因素;若结果异常则进行QUS检查,进一步监测PTH和25-(OH)D,若QUS、PTH和25-(OH)D正常,每2~4周监测1次血钙、血磷、ALP、TRP、PTH,持续3个月,若QUS、PTH和25-(OH)D异常,则应予矿物质补充剂治疗,并且每1~2周监测血钙、血磷、ALP、TRP、PTH、尿钙/尿肌酐。芬兰Backström等[31 ]的前瞻性研究显示,早产儿在校正胎龄3周和3个月、6个月时监测血磷和ALP,以ALP900 IU/L和血磷1.8 mmol/L为标准诊断MBDP的特异度为70%,灵敏度达100%。西班牙Avila-Alvarez等[32 ]的观察性研究将ALP900 IU/L和血磷1.8 mmol/L作为MBDP的诊断标准,具有上述两项之一被认为是MBDP高风险患儿,结果显示MBDP在出生胎龄≤32周、出生体重≤1 500 g的早产儿中患病率为12.3%。法国Motte-Signoret等[33 ]的前瞻性研究认为,应在生后15 d监测ALP,如果ALP500 IU/L,应补充钙、磷或骨化三醇以预防骨矿化减少。
日本京都大学医院MBDP的筛查策略为:若早产儿ALP458 IU/L应监测血磷,如血磷1.6 mmol/L则进一步监测TRP,TRP93%提示缺磷,予以补磷治疗;如TRP≤93%则监测血钙、25-(OH)D,若怀疑甲状旁腺功能亢进应监测PTH并进行腕部X线 mmol/L,且TRP≤93%,则监测血钙、25-(OH)D,若TRP正常进一步监测尿钙/尿肌酐,该比值升高提示维生素D缺乏,该比值降低则提示缺钙[34 ]。
我国2021年早产儿代谢性骨病临床管理专家共识[1 ]认为早产儿ALP900 IU/L,伴血磷1.8 mmol/L高度提示MBDP;生后3周PTH180 pg/ml,伴血磷1.5 mmol/L,提示严重MBDP。中国医师协会组织的全国MBDP危险因素多中心回顾性调查中MBDP的诊断标准为:(1)血磷1.8 mmol/L,和(或)ALP500 IU/L;(2)多汗、夜惊等佝偻病相关临床表现;(3)广泛性骨矿化减少、骨质变薄,骨骺段钙化带消失或典型佝偻病骨骼X线),可诊断MBDP[35 ]。Zhang等[36 ]的回顾性研究发现胎龄≤31周的超低出生体重儿生后3~4周MBDP发生率最高,建议生后2周开始做生化筛查。台湾谭银玲等[37 ]研究认为血磷1.2 mmol/L是MBDP的最早期标志,建议超低出生体重儿生后2周开始监测血磷。2023年吕奎林等[38 ]提出的针对生后3~30 d,出生胎龄32周,出生体重1 500 g早产儿模型的MBDP诊断阈值为ALP≥344 IU/L。
多数国家均建议监测血磷、ALP、PTH等生化指标以筛查MBDP,但目前尚无统一诊断标准,生后监测时间也存在争议,可能与不同研究对MBDP的定义、研究对象的胎龄和出生体重的差异有关。虽然仅用ALP和血磷诊断MBDP可能会引起过度诊断,有一定局限性,但由于高危儿骨矿化不良往往发生早且严重,而ALP与血磷结果简单且较易获得,因此临床上通过监测ALP与血磷早期筛查MBDP是切实可行的,可进一步结合QUS等相关检查,以早期预防性治疗或诊断MBDP。因此规范制订MBDP筛查、诊断及防治的统一标准和QUS常用参数的标准参考范围是亟待解决的问题。通过射频超声频谱检查进行宫内筛查,制定产前干预策略,优化孕妇营养和胎儿宫内发育,对MBDP进行更早期的预防与筛查可能是未来的研究方向。
新生儿脐静脉置管/经外周中心静脉置管相关心包积液/胸腔积液10例临床分析
“糖妈妈”健康必读(四)孕妇为何需要做口服葡萄糖耐量试验(OGTT)?
“糖妈妈”健康必读(四)孕妇为何需要做口服葡萄糖耐量试验(OGTT)?
脐血S100β蛋白及乳酸联合振幅整合脑电图对小于胎龄早产儿脑损伤的早期预测研究
联系我们
服务热线
乐鱼app下载: 乐鱼官网_官方app下载
邮编: 518126
联系人: 王经理
热线: 400-800-7156
电话: 0755-26414638
传真: 0755-26522816
邮箱: szcreate@163.com
QQ: 631045164





 首页
首页
 产品
产品
 案例
案例
 联系
联系